0. 순서
1. 배터리 관련 기초 지식 및 용어
1.1 배터리란
1.2 배터리 관련 용어
1.3 배터리의 종류
2. 리튬이온배터리
2.1 리튬이온배터리의 구조
2.2 리튬이온배터리의 특징
2.3 리튬이온배터리의 충/방전 과정
2.4 리튬이온배터리의 종류
2.5 리튬이온배터리의 위험성
3. BMS
3.1 BMS란
3.2 BMS의 역할
3.3 BMS 구조
4. Cell Balancing
4.1 Cell Balancing이란
4.2 Cell Balancing의 종류
5. 배터리 SoX 추정
5.1 SoC 추정
5.2 SoH 추정
1. 배터리 관련 기초 지식 및 용어
1.1. 배터리란
- 배터리, 전지 (Battery) : 전기 장치에 전원을 공급하기 위해 화학에너지를 저장하다가 이를 필요할 때 전기로 변환하여 직류 전력을 생산하는 한 개 이상의 Cell로 이뤄진 기기
- Cell : 가장 작은 전기화학적 단위. 구성 물질 (화학 물질, 화합물)에 따라 전하를 저장하거나 회로에 전원 공급을 위해 운반할 수 있다
- Pack (Battery Pack) : 배터리들이 직렬 혹은 병렬로 연결된 형태
- 전하 (Electric Charge) : 전자기장 내에서 전기현상을 일으키는 물체의 전기적 성질. 모든 전기적 효과는 전하의 분포와 움직임 등의 성질에 따라 바뀜
- Charge의 SI 단위는 C(Coulomb)이며 1Ah = 3600C임
- 즉 배터리는 화학에너지를 전기에너지로 변환하여 공급하는 장치
- 전기는 전자가 (-)극 -> (+)극 으로 이동할 때 발생
- 이를 위해 반응성이 커 (전자를 방출하기 쉬움) 산화되기 쉬운 물질을 (-) 극으로 삼고
반응성이 작아 환원되기 쉬운 (전자를 받아들이기 쉬움) 물질을 (+) 극으로 삼음 - (-) 극에서 나온 전자가 환원되려고 하는 (+)극의 물질로 자발적으로 이동하며 전류가 생성
- 산화 (Oxidation) : 이온에서 전자가 분리되어 빠져나오는 것
- 환원 (Reduction) : 이온에 전자가 붙어 합쳐지는 것

- 즉 배터리는 위의 화학적 과정 중 하나인 산화 - 환원 반응 (Redox (Reduction - Oxidation) Reaction)을 통해 전기적 에너지를 발생시킴
- 이온 (Ion) : 원자/분자의 특성한 상태를 나타내는 용어. 전자를 잃거나 얻어 양/음전하를 띄는 원자/분자를 나타냄
- 중성자 (Neutron)가 한 개 이상의 전자를 잃으면 원자는 양전하를 띄게 되어 양이온 (Cation)이 됨
- 중성자가 한 개 이상의 전자를 얻으면 원자는 음전하를 띄게 되어 음이온 (Anion)이 됨
- 이온전도 (Ionic Conduction) : 이온에 의해 전하가 운반되는 전기전도
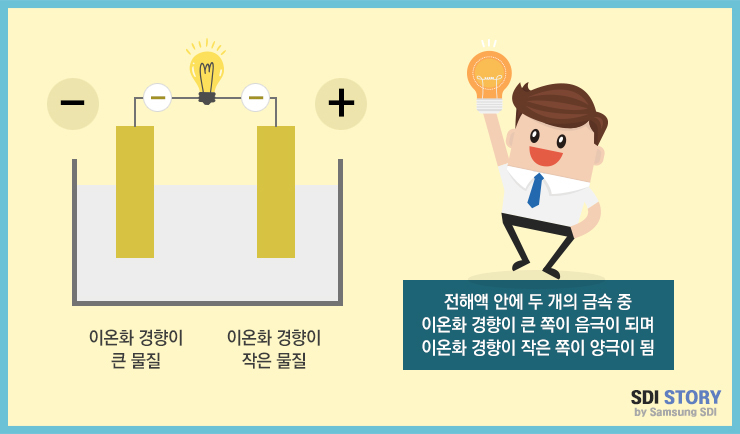
- 위처럼 이온화 경향이 서로 다른 두 물질을 이용하여 배터리를 만들 수 있고, 경향성이 큰 금속과 작은 금속을 조합하면 더 큰 전압을 갖는 배터리를 만들 수 있다
- 이온화 : 전하적으로 중성인 분자가 양 또는 음의 전하를 가진 이온으로 변하는 현상
- 이온화 경향 (Ionizaiton Tendency) : 수용액에서 원소의 이온이 되기 쉬움을 나타냄
- 금속이 액체와 접촉하였을 때 전자를 잃고 양이온이 되려고 하는 경향
- 이온화되기 쉽다는 말은 반응성이 크다, 혹은 전자를 방출하기 쉽다 (산화되기 쉽다)를 의미
- Cell을 직렬(Serial) 연결할 경우 전압은 각 Cell들의 전압의 합이며, 용량은 동일하다
- Cell을 병렬(Parallel) 연결할 경우 전압은 동일하며, 용량은 각 Cell들의 용량의 합니다
- Ex) 2V, 20Ah Cell의 직/병렬 연결


- 왼쪽의 직렬 연결의 경우 V : 6V, C : 20Ah
- 오른쪽의 병렬 연결의 경우 V : 2V, C : 100Ah
1.2. 배터리 관련 용어

- 배터리 용량 (Battery Capacity) : 배터리가 양쪽 극에서 가지고 있는 전자의 수. 즉 배터리가 저장할 수 있는 전자(전기)의 양 [Ah]
- 전자들이 (-)극 -> (+)로 이동할 때 전기를 발생시켜 전자기기를 동작시키는 것
- Ex) 2mAh : 2mA의 전류로 1시간 동안 사용할 수 있는 배터리 용량 (전하 용량)
- 단 배터리의 에너지양은 배터리 용량과 전압을 곱한 값으로, 용량과는 다른 값임
- 공칭 용량 (Nominal Capacity) : 상온(25°C)에서 측정한 배터리의 용량
- 배터리 전압 ( '' Voltage) : 양극과 음극의 전압 차이량 [V]
- 배터리 전압은 양극의 활물질에 따라 달라짐
- 리튬이온배터리의 경우 활물질에 저장된 리튬의 양이 용량을 결정하며 보통 리튬은 3.7V0
- 활물질 (Active Material) : 배터리의 양극과 음극에서 화학적으로 반응하여 전기 에너지를 만들어내는 활성물질
- 공칭 전압 (Nominal Voltage) : 배터리의 정격 전압. 선로의 이상적인 전압값을 의미
- 편리한 선택을 위해 특정 전압 등급의 Cell 또는 배터리에 할당된 값
- 동작 전압은 이와 다를 수 있다
- 대부분의 리튬이온 배터리는 3V 이상의 Nominal Voltage 값을 가짐
- 배터리 에너지양 (Battery Energy) : 배터리 용량 x 배터리 전압 [Wh]
- 배터리를 얼마나 오래 쓸 수 있느냐는 용량의 크기와 상관없이 에너지양에 의해 결정됨
- Ex) 20V, 4000mAh, 소비 전력 40W -> 에너지양 : 20V x 4000mAh = 80Wh
- 80Wh / 40W = 2h. 즉 2시간 정도 사용 가능
- 공칭 에너지 (Nominal Energy) : 공칭 용량의 방전 곡선을 적분한 값
- 에너지 밀도 (Energy Density) : 배터리의 중량, 부피당 가지는 에너지양
- 배터리 용량을 늘리거나 전압이 더 높은 활물질을 사용하여 에너지 밀도를 높일 수 있다
- C(Current) Rate : 배터리의 정격 용량 대비 충/방전 전류의 비율. 충/방전율이라 부름
- 표준값은 1C. 1C는 1A의 전류로 1시간 동안 충전 혹은 방전 하는 것을 의미
- 이 C Rate 값을 통해 배터리의 충/방전 소요 시간을 알 수 있음
- Ex) 0.5C 충전 : 배터리 정격 용량 대비 1/2 용량의 전류로 충전 가능. 완충에 2시간 소요
- Ex) 5C 방전 : 정격 용량 대비 5배 용량의 전류를 소모 가능. 완전 방전에 12분 소요

- 방전 시 C Rate가 높을 경우 활물질이 완전히 사용되지 않아 방전이 계산 시간보다 빨리 됨
- 전류가 높을 수록 Cell 내부에서 더 많은 에너지가 열로 소모됨
- 또한 Cell의 저항으로 인해 발생하는 IR Drop으로 인해 단자 전압 또한 낮아진다
- OCV (Open Circuit Voltage) : 배터리에 아무것도 연결하지 않은 상태에서 배터리에 걸리는 기전력
- 즉 전류가 없는 상태에서 측정한 전압값
- 아무런 저항요소가 없을 때 사용 가능한 최고치의 전압이며, 이는 SoC에 따라 변함 (OCV는 SoC에 비례)
- 기전력 (Electromotive Force) : 전기회로에서 전압을 발생시키는 역할로, 낮은 Potential에서 높은 Potential로 단위 전하를 이동시키는데 필요한, 단위 전하당 한 일
- 충/방전 과정에서의 OCV는 Hysteresis 특성을 갖는다
- Hysteresis 특성 : 어떤 값이 그 값 전까지 해당 물질이 경과해온 과정에 따라 달라지는 특성

- SoC (State of Charge) : 배터리의 전체 용량 대비 잔여 용량의 비율 [%]
- DoD (Depth of Discharge) : 배터리의 방전 상태를 나타내는 지표. 제거된 Charge의 비율 [%]

- 위의 SoC와 DoD는 단순히 Inverse 관계가 아님
- SoH (State of Health) : 배터리의 잔존 수명 대비 현재 성능 상태를 나타내는 지표
- 배터리의 최초 성능 대비 현재 배터리의 성능 수준을 나타냄
- 배터리는 사용할수록 내부 저항이 증가하여 용량이 열화되는 제품
- SoH는 그 열화의 정도를 나타내는, 즉 배터리의 수명을 나타내는 지표
- 열화 : 재료가 외부 요인으로 인하여 화학적/물리적 성질이 나빠지는 현상
- 방전 (Discharge) : 배터리가 외부에 전기에너지를 공급하는 일
- 양극과 음극을 도선으로 연결하면 음극에 존재하는 리튬 이온이 양극으로 자발적으로 이동함
- 충전 (Charge) : 방전의 반대 과정으로, 배터리가 에너지를 공급받고 축적하여 대전체가 전하를 얻는 것
- 자발적 현상인 방전과 달리 충전은 (+)극에서 (-)극 방향으로 전자를 이동시켜야 하므로 전원장치인 충전기의 도움을 받음
- 일정용량 이상 충전이 이뤄지면 화학반응을 할 수 있는 이온과 전자의 개수가 줄어들어 충전 속도가 느려짐
- Cutoff Voltage : 배터리가 완전히 충/방전된 것으로 간주되는 Voltage. 배터리의 과충전 및 과방전 방지를 위해 설정하는 값. 일부 전자기기 (핸드폰)들은 배터리가 하한 전압 아래로 떨어지먼 종료된다
- Upper Cutoff Voltage (상한 전압)
- Lower Cutoff Voltage (하한 전압)
- 대전 (Electrification) : 물체가 전기를 띄는 현상
1.3. 배터리의 종류
- 충전 가능 여부에 따른 구분
- 일차 전지 (Primary Cell) : 일회성으로 사용하는 배터리. 산화되어 전자를 잃으면 다시 환원되지 못함 (비가역적)
- 방전 과정에서 화합물이 영구적으로 변하고, 본래의 화합물이 완전히 소진될 때 까지 전기 에너지를 방출한다
- 따라서 일차 전지는 한번만 사용 가능하다
- 이차 전지 (Secondary Cell) : 반영구적으로 사용 가능한, 충전이 가능한 배터리. 산화/환원 반응을 다시 일으킬 수 있음 (가역적)
- Cell 자체의 전위보다 더 높은 전위값이 양 전극에 인가된다면 본래의 화합물이 재구성될 수 있다
- 이는 Cell에 에너지를 주입하여 전자와 양이온이 양극에서 음극으로 복귀하도록 만들어 전하를 저장하게 한다
- 위 과정이 충전 과정이다
- 본 글에서는 이차전지를 위주로 다룸
- 외형에 따른 구분
- Cylindrical (원통형)
- 장점 : 가장 오래된 형태로 오랜 시간 공정기술이 발달하여 생단 단가가 저렴함. 금속 캔을 외부 케이스로 사용하여 내구성 우수
- 단점 : 부피당 에너지 밀도는 높으나 다른 형태에 비해 용량이 상대적으로 작아 팩 단위로 구성 시 셀 사이사이에 Dead Space(빈 공간)이 생겨 에너지 밀도가 낮음

- Prismatic (각형)
- 장점 : 알루미늄 캔으로 둘러쌓여 있어 내구성이 뛰어남
- 단점 : 에너지 밀도가 상대적으로 낮음. 알루미늄 캔때문에 무게가 무겁고 제조 공정이 상대적으로 복잡함
- 외부 케이스는 사각이나 젤리롤은 원통형이므로 남는 공간이 있음
- Pouch (파우치형)
- 장점 : 다른 형태와 달리 소재를 적층하여 남는 내부 공간 없이 꽉 채워 에너지 밀도가 높고 용량이 큼.
- 외부 케이스가 유연하여 다양한 크기와 모양 선택 가능하며 접거나 구부릴 수 있어 활용도가 높음 (갤럭시 폴드에 파우치형 배터리 2개가 사용됨)
- 단점 : 다른 형태에 비해 외부 케이스가 튼튼하지 않아 별도의 보호 커버 등이 필요함



- 외형에 따라 내부 저항 또한 달라진다
- Cylindrical : 내부 저항 높음
- Prismatic, Pouch : 내부 저항 낮음
- 구성 물질에 따른 구분 (이차 전지 중)
- Lead - Acid Battery (납 축전지, 납산 배터리) : 납과 황산을 이용한 이차 전지
- 주로 자동차 전장 장치에 전기를 공급하는 역할인 자동차 배터리로 사용됨
- 장점 : 다른 이차 전지에 비해 용량과 전압이 큼. 가격이 저렴함. 재활용 가능한 재료로 구성되어 친환경적
- 저온 및 고온에서 성능이 좋음
- 단점 : 수명이 짧음. 리튬이온배터리에 비해 에너지 밀도가 낮음. 충방전 수명이 비교적 짧음


- NiH2 Battery (Nickel Hydride Battery. 니켈수소배터리) : 양극에 니켈, 음극에 수소 저장 합금, 전해질에 알칼리 기반의 수용액을 사용한 이차 전지
- 1세대 하이브리드 차량 또는 전기자동차의 배터리로 활용됨
- 장점 : 용량이 크고 수명이 김
- 단점 : 방전 속도가 빠름. 충전 시간이 길고 횟수가 제한적임. 리튬이온배터리에 비해 에너지 밀도가 낮음


- Li-Ion Battery (Lithium Ion Battery. 리튬이온배터리) : 방전 과정에서 리튬이온이 (-)극 -> (+)극으로 이동하는 화학적 반응을 통해 전기를 만들어내는 이차 전지
- 충전시에는 반대로 이동
- 즉 양 전극에서의 Lithuim Intercalation 반응을 사용하는 이차 전지
- Lithium : 알칼리 금속에 속하는 화학 원소
- 장점
- 다른 이차 전지에 비해 높은 전압에서 동작할 수 있고, 이로 인해 높은 에너지 밀도를 갖는다
- 부하 저항과 Cell의 저항이 같을 때 최대 Power 추출
- Power 절반은Cell 내부에서 열로 소모되고 나머지 절반이 Cell 외부로 추출
- 단 내부 열로 인해 온도가 위험 수준까지 높아져 오래 지속되진 않는다
- 상대적으로 낮은 자가 방전율을 갖는다. 메모리 효과가 없어 수명이 길다
- 메모리 효과 (Memory Effect) : 배터리를 완전히 방전되기 전 재충전하면 충전량이 남아있음에도 충전기가 완전 방전으로 기억하여 소모된 용량만 충전 가능한 용량으로 인식하여 사용 가능 용량이 줄어드는 현상
- 방전 전압이 떨어져 용량이 줄어든 것으로 보이는 것이지 실제 용량이 줄어든 것은 아님
- 본래는 니켈을 사용하는 이차 전지에서 완방 전 재충전을 할 경우 최대 에너지 용량을 잃는 것을 의미하였으나, 현재는 배터리가 예측값보다 덜 충전되는 현상 자체를 의미
- 단점
- 과충전 시 폭발의 위험이 있는 등 다른 이차 전지에 비해 안정성이 떨어지며 비용이 높다
- 다른 종류의 리튬이온배터리는 내부 전기화학적 구성이 달라 서로 호환되지 않고 각자를 위한 충전기가 따로 필요하다
- AA, C, D 등의 표준 Cell의 크기로 사용할 수 없다


2. 리튬이온배터리
2.1. 리튬이온배터리의 구조

- 리튬이온배터리의 4가지 주요 성분은 아래와 같다
- 음극 (Negative Electrode). Anode
- 양극 (Positive Electrode). Cathode
- 전해질 (Electrolyte)
- 분리막 (Separator)
+ 집전체 (Current Collector)

1. 음극 (Anode)
- 방전 시 전자를 외부의 회로에 전달 : 산화(Oxidation) 작용
- 전자를 잃어 양전하를 띔
- Anode는 전류가 흘러 들어가는 쪽의 전극을 말하며, 배터리처럼 전력을 생산 / 공급하는 장치에서는 음극을 의미
- Anode와 Cathode는 전극에서 일어나는 화학반응을 근거로 결정됨
- 충전된 상태에서 리튬 이온이 머무는 곳으로, 리튬이온을 받아들이거나 내보내 전류가 흐르게 하는 역할을 함
- 배터리 충전 시 리튬 이온은 음극에 존재
- 양극과 음극을 도선으로 연결
- 리튬 이온이 전해질을 통해 양극으로 이동
- 리튬 이온과 분리된 전자는 도선을 따라 이동하며 전기를 발생

- 배터리의 충전 속도와(리튬 이온을 얼마나 잘 받아들이는가) 수명(리튬 이온을 얼마나 많이 저장할 수 있는가)을 결정
1.1. 음극재의 재료
- 음극 활물질은 방전 시 양극에서 온 리튬 이온을 저장 및 방출하여 전기 에너지를 발생시키는 역할
- 보통 많은 이온을 안정적으로 저장할 수 있고 리튬 이온의 이동(충/방전)에 안정적인 Graphite(흑연, C6)을 주로 사용
- 흑연은 탄소 원자들이 육각형 형태로 단단하게 결합되어 2차원 평면을 이루고 있는 구조인 Graphene이 여러 층 쌓여있음

- 단 리튬 이온을 저장하고 방출하는 충/방전 과정이 반복될 수록 흑연의 구조가 변화함 (조금씩 틀어짐)
- 충전 시 양극에 있던 리튬 이온이 음극으로 이동하여 흑연 층 사이사이로 들어가는데, 이 때 흑연이 팽창하고, 팽창된 시간이 지날 수록 흑연의 구조 변화를 일으킴
- 이로 인해 배터리 수명이 단축되어 이차 전지의 수명을 결정
- 흑연의 규칙적 구조 덕분에 리튬이온이 사이사이에 안정적으로 삽입될 수 있어 음극재 소재로 적합함
- Graphene층들은 서로 느슨하게 쌓여있고, 약한 Van Der Waals Force에 의해서만 결합되어 있음
- Van Der Waals Force : 비극성 분자간의 근접한 거리에서 발생하는 인력
- 전자가 항상 원자 혹은 분자 주위에 균일하게 분포되어 있지 않아 이로 인해 순간적인 쌍극자가 생성되고, 인접한 분자에서 일시적인 편극이 일어나 유도쌍극자가 생성된다
- 이러한 쌍극자와 유도 쌍극자 간의 인력을 의미
- 리튬이온이 이 층들의 사이사이에 삽입된다

- 회색 구가 탄소 원자, 보라색이 리튬 원자
- Graphene 층 사이에는 리튬 원자가 자유롭게 이동할 수 있는 충분한 공간이 있다
- 리튬이온 Cell에는 몇가지 형태의 흑연이 사용된다


- 선은 Graphene 부분을 의미하며, 리튬이 Graphene 층간의 공간에 존재할 수 있다
- 입자의 미세구조 내부의 Graphene 층들의 통일성의 정도에 차이가 있다
- 천연 및 합성 흑연은 가장 단단한 경향이 있다
- 자연적으로 단단하거나 무질서한 탄소는 무작위로 배열되어 Graphene 층에 많은 작은 공간을 가져 통일성이 덜하다
- 다른 형태의 흑연은 다른 전압 특성, 용량과 노화 특성을 가지나 본직적으로는 같은 형태로 동작한다
- 흑연에 저장될 수 있는 리튬의 최대 양은 탄소 원자 6개당 하나의 리튬 이온이다
- 따라서 흑연 전극의 Lithiation(양극에 리튬 원자가 들어오는 것)의 정도를 아래와 같이 표현한다 (0 ≤ x ≤ 1)

- 원자 수준에서 볼 경우 주어진 C6위치에는 단일 리튬 원자가 있거나 전혀 존재하지 않는다
- 하지만 전체 전극을 고려할 경우 전체 C6의 위치의 수 중 일부가 점유되어있고, 그 값이 x이다
- 충전 시 음극이 높게 리튬화되고, x는 1에 가까워지며 방전 시 음극이 크게 탈리튬화되고, x는 0에 가까워진다
- 천연 흑연의 경우 리튬이온 저장용량이 크고 전기저항이 낮으며 생산 비용이 저렴하다는 장점이 있다
- 하지만 리튬이온 삽입 시 입자 내부 구조가 팽창하고 표면이 불안정해 삽입, 방출 능력이 저하되어 배터리 수명이 감소하여 낮은 장기신뢰성이 있다는 단점이 있다
- 인조 흑연의 경우 입자 내부 및 표면이 안정적인 구조를 형성해 천연흑연에 비해 팽창이 적고 충/방전 횟수에 따른 용량 감소율이 낮은 장수명 특성을 지녀 수명 성능이 우수하며 고속 충전이 가능하다는 장점이 있다
- 반면 생산 비용이 높고 상대적으로 에너지밀도가 낮다는 단점이 있다
- 최근에는 흑연 대비 무게 당 용량이 더 커 에너지밀도를 높일 수 있는 실리콘이 주목 받고 있음
2. 양극 (Cathode)
- 충전 시 외부 회로로부터 전자를 받음 : 환원(Reduction) 작용
- 리튬 이온의 방출과 전자의 움직임에 관여
- 전자를 얻어 음전하를 띔
- 방전 시 리튬이 들어가는 공간으로, 배터리의 용량과 전압(출력)을 결정
- 양극재의 리튬 비중이 높을수록 용량 증가
- 배터리의 전압은 양 전극의 전위차에 의해 결정되므로 양극의 구조에 따른 전위값이 클수록 전압 증가
- 알칼리 금속에 속하는 리튬은 전자를 잃고 양이온이 되려는 경향이 강해 양극 소재로 적합함
- 즉 반응성이 매우 커 이온화되기 쉬운 경향을 가짐
- 하지만 반응성이 너무 커 원소 상태의 리튬 이온은 불안정하므로 리튬과 산소를 결합시킨 리튬산화물(Li+O)의 형태를 배터리의 활물질로 사용함
- 알칼리 금속은 반응성이 높아 최외각 전자 껍질의 전자 하나를 쉽게 잃고 +1가의 양이온으로 존재하기 쉬움

- 이로 인해 충/방전 시 리튬 원자가 리튬 이온과 전자로 이온화되는 현상이 발생
- 앞서 설명했듯 이온화되기 쉽다는 말은 반응성이 크다, 혹은 전자를 방출하기 쉽다 (산화되기 쉽다)를 의미
- 즉 금속이 액체와 접촉하였을 때 전자를 잃고 양이온이 되려고 하는 경향이 큼
2.1. 양극재의 재료
- 양극재는 음극재에 비해 재료의 다양성이 훨씬 많다
- 현재 주로 사용되는 NCM, LFP Cell의 경우 전이 금속(Ni, Co, Mn, Al)이 활물질 역할을 함
- NCM : Ni(니켈), Co(코발트), Mn(망간)
- LFP : Fe(철)
- 전이 금속(Transistion Metal) : 3 ~ 12족에 해당하는 원소. 원자 번호 순으로 원소를 나열하면 전형 원소로 전이되는 중간 단계 역할을 한다 하여 '전이'라는 이름이 붙여짐

- 양극 활물질은 리튬 이온을 갖고 있다가 충전 시 음극으로 리튬 이온을 제공하는 역할을 함
- LCO, LMO, NCM, NCA, LFP 등 필요에 따라 여러 물질의 특성을 조합하여 사용
3. 전해질 (Electrolyte)
- Cell 내부의 리튬 이온이 양 전극 사이를 움직일 수 있게 매개 역할을 하는 Ionic Conductor (이온 전도체)
- 충/방전 시 리튬 이온이 전해질에 녹아들어 양극과 음극 사이를 이동함
- 리튬 이온의 원활한 이동을 위해 이온전도도가 높아야 하며 전자의 출입은 막아 외부 도선으로만 이동하도록 해야 함
- 부도체로써 전자에 대한 전도성이 없도록 설계된 물질을 사용하여 전자의 출입을 막음 (내부 단락 방지)
- 수용액 상태에서 Ion으로 쪼개져 전류가 흐르는 물
- 크게 리튬염, 유기용매, 첨가제로 구성되어 있음
- 리튬염 (Lithium Salt) : 리튬 이온을 이동시키는 통로 역할. 리튬 이온이 이 염에 녹아들어 이동함
- 유기용매 (Organic Solvent) : 리튬염을 잘 용해시켜 리튬 이온이 염에 잘 녹아들도록 돕는 역할
- 액체 전해질은 용매가 물이며 보통 이온 전도도를 제공하는 용질을 포함하고 있는 액체로 구성됨
- 이온 전하 전달이 Acid(산)이나 Base(염기), 혹은 Salt(염)을 통해 이뤄짐
- Acid : 양성자를 제공하는 물질
- Base : 양성자를 받아들이는 물질
- Salt : Acid의 음이온과 Base의 양이온이 정전기적 인력으로 결합한 이온성 화합물
- 첨가제 (Additives) : 특정한 목적을 위해 5% 이하의 매우 소량으로 첨가되는 물질
- 양 전극에 보호막을 형성하고 리튬이 양 전극 사이를 원활하게 이동할 수 있도록 하여 배터리의 성능을 보완하고 수명과 안정성을 향상시킴
- 양극용, 음극용으로 나뉘며 양극용의 경우 양극 구조 안정화나 열화 방지 및 발열 개선, 과충전 방지 역할을 함
- 음극용의 경우 용매보다 먼저 분해되어 음극에 막을 형성해 수명을 향상시킴
- 알칼리 금속에 속하는 리튬은 물과 만나면 수소 기체를 발생시키며 반응한다
- 따라서 리튬이온배터리의 전해질은 비수성 유기 용매에 리튬염이 추가된체로 구성되며 화학 반응에 참가하지 않는 이온 전도체 역할을 한다
- 이러한 액체 전해질을 사용하는 Cell은 물 속의 산소와 수소가 2V 이상의 전압에서는 dissociate 되므로 단자 전압을 2V 아래로 제한한다
- 단자 전압 (Terminal Voltage) : 단자 사이에 장치나 부하가 연결되어 있을 때의 전압
- Cell의 전체 전압이 2V를 넘는다면 Non-Aqueous(비수성) 전해질을 사용해야 한다
- Dissociate (해리) : 분자가 자신을 구성하고 있는 각 원자나 이온, 혹은 그보다 작은 물질로 분해되는 현상)
- 최근에는 고체 전해질인 전고체에 대한 연구가 활발히 이뤄지는 중
- 고체 상태라서 발열 및 인화 위험이 없고 외부의 충격에 강하며 액체보다 밀도가 높아 에너지 효율을 높일 수 있다
- 단 아직은 가격이 높다는 단점이 있다
- Lithium Ploymer(LiPo) Cell은 Polymer나 Gel Electrolyte를 사용
- 다른 Cell들은 Nonaqueous(비수성. 물에 용해되지 않음)한 Liquid Electrolyte를 사용
- 겨울철에는 전해질이 차가워져 리튬 이온의 이동속도가 느려짐 -> 내부 저항이 생겨 배터리 효율 저하
4. 분리막 (Seperator)
- 절연 소재로 이뤄진 얇은 막으로, 리튬 이온은 통과시키며 양극과 음극을 물리적으로 분리하여 내부 단락을 방지
- 이를 통해 내부 단락 발생으로 인한 자가 방전 현상을 방지
- 분리막 표면의 매우 미세한 기공을 통해 리튬 이온이 이동
- 배터리 내부 온도가 일정 수준 이상으로 상승하면 기공이 막혀 리튬 이온의 이동을 차단하여 내부 쇼트 발생 차단
- Ionic Conductor이며 Electronic Insulator (전자 절연체)임

- 분리막은 보통 절연 특성이 뛰어난 폴리에틸렌(Polyethylene, PE), 폴리프로필렌(Polypropylene, PP) 등으로 구성됨
- 제조 방식에 따라 건식과 습식으로 나뉨
- 건식 : 기계적 힘을 통해 PE, PP 필름 원단을 한 방향으로 잡아당기고 물리적인 연신(원료를 가늘게 늘이는 공정)과 열처리 공정을 통해 기공을 만드는 방식
- 장점 : 공정이 간단하여 대량 생산이 가능하나 기공의
- 단점: 크기를 균일하게 만드는 것과 막을 얇게 만드는 것이 어려움
- 따라서 기공의 크기가 불균일하며 두꺼워 에너지밀도를 높이기게 부적합하며 습식에 비해 기계적 강도가 약함
- ESS(Energy Storage System. 에너지 저장 장치), 전기 버스처럼 에너지 밀도가 크게 높을 필요가 없는 분야에 주로 사용
- 습식 : PE, PP에 파라핀 오일을 섞은 후 고온, 고압의 압출과 연신, 화학처리 등의 과정을 거친 후 필름 틈의 오일을 추출하여 기공을 만드는 방식
- 장점 : 한 방향으로만 필름을 늘리는 건식과 달리길이, 폭을 모두 늘려 기공이 균일함
- 또한 건식에 비해 얇아 높은 에너지밀도를 확보할 수 있다
- 단점 : 공정이 복잡하고 사용하는 소재가 많아 단가가 높다
- 휴대폰, 노트북 등의 소형 배터리나 EV(Electric Vehicle. 전기자동차) 등의 고용량과 고출력이 필요한 분야에 주로 사용
앞으로는 배터리의 소형 / 경량 / 고용량화 트렌드에 맞춰 습식 분리막의 수요가 증가할 전망
+ 집전체 (Current Collector)
- Cell의 충/방전 과정에서 발생하는 전자들을 외부로 전달하는 통로 역할
- 배터의 충/방전 시 전기화학 반응이 일어날 수 있도록 전극에서 생성된 전자를 Cell 외부로 전달하거나, 외부의 전자를 받아 전극 내부로 전달하는 역할을 한다
- 리튬이온배터리의 경우 양극과 음극을 집전체로 코팅함
- 음극재의 집전체는 Copper Foil(구리막), 양극재의 집전체는 알루미늄 막으로 만들어진다

- 배터리 내부에 매우 얇은 막 형태로 존재하며 충 / 방전 시 전자가 이동하여 전기화학반응이 일어날 수 있도록 함
- 전극 근판의 형상을 위한 중요 재료
- Cell에서의 화학적 반응에 참여하진 않으나 재료들로의 전자적 연결을 손쉽게 하거나 전극의 저항을 감소시킨다
- Dry Cell(건전지)의 경우 양극재에 탄소로 만든 집전체를 사용한다
- Dry Cell : 전해질을 흡착제나 분리막에 포함시켜 수분이 거의 없는 상태가 되게 한 일차 전지
- 양극은 망간, 음극은 아연을 사용한다
2.2. 리튬이온배터리의 특징
- 리튬이온 Cell은 다른 전기화학적 Cell과 동작 방식이 다르다
- 전통적인 전기화학적 Cell의 경우 전극의 반응 물질을 화학적으로 바꾸는 산화환원 작용에 의존한다
- Ex) Lead - Acid Cell(납 축전지)의 경우 방전 시 음극제에서 lead(납)이 HSO4-(황산수소이온)과 반응하여 전해질 내부에 Hydrogen Ion (수소 이온. 양성자)를 생성하고 두개의 전자를 외부 회로에 방출하고 고체 lead sulfate(황산 납) 결정을 음극 표면에 생성한다
- 이를 아래 식으로 표현할 수 있다

- 양극에서는 전해질로부터의 lead oxid(PbO2. 산화납)과 HSO4-이 Hydrogen Ion과 반응하여 전자를 소모하고 고체 lead sulfate 결정을 양극 표면에 생성한다
- 이를 아래 식으로 표현할 수 있다

- 리튬이온 Cell은 위와 달리 전극 재료와 그 자체로는 반응하지 않는다
- 대신 리튬이 전해질에 흡수되어 전극 재료의 구조로 들어간다
- 이처럼 층상구조를 띈 물질의 사이에 분자나 이온이 들어갔다 나오는 현상을 Intercalation(층간 삽입)이라 한다
- 반대로 층간 삽입된 이온이나 분자가 층에서 빠져나오는 현상을 Deintercalation이라 부른다
- 위 동작을 위해선 전극이 아래의 두가지 중요한 성질을 지녀야 한다
- 리튬이 자유롭게 이동할수 있을 만큼의 넓은 통로로 가득 찬 개방형 결정 구조를 가져야 한다
즉 리튬이 전해질에서 전극 구조의 빈 공간으로 들어가거나 반대로 빈 공간에서 제거될 수 있고 결정 구조 내의 빈 공간 사이를 자유롭게 이동할 수 있어야 한다 - 전극이 보상 전자를 외부 회로에 전달하거나 공급받을 수 있어야 한다
- 리튬이 자유롭게 이동할수 있을 만큼의 넓은 통로로 가득 찬 개방형 결정 구조를 가져야 한다
- 결정 구조 자체는 리튬의 삽입이나 제거로 인해 화학적으로 변하지 않으나 결정 구조는 변할 수 있다

- 리튬은 전극 내부에 중립 중성 원자의 형태로 저장되어있다
- 각 리튬 원자의 원자가전자는 결정 구조 내부의 이웃 원자와 매우 가깝게 공유된다
- 원자가전자(Valence Electron) : 원자의 최외곽껍질에서 화학 반응에 참여하는 전자
- 따라서 리튬은 한 곳에 단단히 묶여있지 않고 자유롭게 이동할 수 있다
- 리튬이 전극 표면으로 들어오고 나가지만 전극의 빈 공간 내부의 리튬 농도를 동일하게 하기 위해 층상 개방형 결정 구조 내에서 확산된다
- 방전 시 음극 표면의 리튬 원자는 전자를 버려 양리튬이온이 되고 전해질 내부로 녹아든다
- 버려진 전자는 외부 회로를 통해 이동한다
- 이 과정을 아래와 같이 표현할 수 있다

- 반대로, 양극 표면 근처의 리튬 이온은 외부 회로로부터 전자를 받아 중성 리튬 원자가 되어 전극 내부의 결정 구조로 들어간다
- 이를 아래와 같이 표현할 수 있다

- 위 과정은 가역적이다 : 리튬 이온은 충/방전 과정 동안 양 전극 사이를 왔다갔다 할 수 있다
- 이 Intercalation Mechanism은 전기화학적 반응보다 훨씬 온화한 편이여서 리튬이온 전지는 다른 이차전지에 비해 수명이 훨씬 긴 편이다
2.3. 리튬이온배터리의 충/방전 과정
1) 방전

- 완전 충전 상태에서 리튬 원자는 모두 음극에 존재
- 이 때 양 전극 사이에 도선이 연결되면 음극 내의 리튬원자가 리튬 양이온과 전자로 이온화되는 산화작용 발생
- 연결된 도선을 통해 전자가 음극 -> 양극으로 이동하여 전류를 발생하여 연결된 부하 (전자기기 등)에 전기 공급
- 음극의 활물질은 전압이 낮고, 양극의 활물질은 전압이 높아 전자가 음극 -> 양극으로 이동함
- 리튬 양이온은 전해핵을 통해 양극으로 이동
- 양극으로 이동한 리튬 양이온과 전자가 다시 만나 리튬 원자로 결합하는 환원작용 발생
- Cation(양이온)은 전해질을 통해 양극으로 이동하고, Anion(음이온)은 음극으로 이동한다 (충전과 반대 방향)
- 음극에서의 전기화학적 Potential 에너지는 외부 회로로 전자를, 전해질로는 양이온을 방출하는 화학 반응을 선호한다
- 양극에서는 외부 회로로부터 전자를, 전해질로부터 양이온을 받는 화학 반응을 선호한다
- 위로 인한 양 단자의 전위차를 'Cell Voltage', 혹은 'Electromotive Force'(EMF, 기전력)이라 부른다
- 양 전극을 도선 등으로 연결하여 전자, 양이온이 음극에서 양극으로 이동할 통로를 생성할 경우 이러한 Potential 에너지를 전기에너지로 활용할 수 있다
- 전해질은 양이온의 이동 통로를 제공하나, 내부 단락 방지를 위해 전자의 이동은 막는다
- 따라서 전자의 이동을 위해선 음극과 양극을 전기적으로 연결하는 외부 전기 회로가 필요하다
- 회로 연결이 완료될 경우, Cell은 자신의 에너지를 회로나 부하를 통해 방전하며 기전력을 전기적 에너지로 변환한다
- 즉 음극재에 있는 리튬이온이 전해질을 통해 양극재로 이동하고, 리튬이온과 분리된 전자가 도선을 통해 이동하며 전기에너지를 발생시킨다
- 이 과정이 방전 과정이다
- 방전 시 전압 곡선이 일정 전류에서 머무르다 부하 상의 Cell 전압이 일정 수준 이하로 감소시 멈춤
- Cell이 완전 방전된 것이 아님
- 전류를 낮춰 여분의 충전량을 방전시킬 수 있음 Ex) Cutoff Voltage에서 방전

2) 충전

- 완전 방전 상태에서 리튬 원자는 모두 양극에 존재함
- 리튬 원자 = 리튬 이온 + 전자
- 산소와 결합된 리튬원자는 구조를 유지하고 싶어하는 안정적인 구조를 가짐
- 따라서 충전을 위해 외부에서 전원을 걸어주면 리튬원자가 산화리튬분자와 강제로 분리됨
- 분리된 리튬원자는 다시 큰 반응성을 가지므로 전자가 분리됨
- 충전 시 리튬원자가 전자로 분리되는 이유
- 이후 양이온이 된 리튬원자는 다시 전기적 중성을 만들기 위해 전해액을 통해 - 극성을 띠는 음극으로 이동함
- 전자들이 충전기에 의해 음극으로 이동하여 음극의 극성이 -가 됨
- 충전 시 양극 내의 리튬 원자가 리튬 양이온과 전자로 이온화되는 산화작용 발생
- 리튬 원자와 분리된 전자는 연결된 도선을 통해 양극 -> 음극으로 이동
- 전자는 전위가 낮은 곳에서 높은 곳으로 자발적으로 이동하며, 충전기가 음극의 전압을 인위적으로 높여 전자가 위의 방향으로 이동할 수 있도록 함
- 단 충전은 방전과 달리 충전기라는 외부 에너지를 통해 전자가 비자발적으로 이동하므로 전류가 발생하지 않음
- 리튬양이온은 전해액을 통해 양극 -> 음극으로 이동
- 음극으로 이동한 리튬 양이온과 전자가 음극의 활물질인 흑연의 층 사이에 저장되어 다시 리튬원자로 결합하는 환원작용 발생
- Cation(양이온)은 전해질을 통해 음극으로 이동하고, Anion(음이온)은 양극으로 이동한다
- 즉 Cell 자체의 전위보다 더 높은 전위값을 양 전극에 인가하여 본래의 화합물을 재구성하는 과정이 충전 과정
- 정리
- 충전 시 충전기가 리튬산화물을 억지로 음극으로 이동시켜 놓음
- 충전 종료 후 전자기기에 연결되면 다시 안정적인 상태로 돌아가려 함
- 전자는 전위가 낮은 음극에서 전위가 높은 양극으로 자발적으로 도선을 통해 이동
- 전해액은 전자의 전도성이 없도록 설계되었으므로 리튬이온만 전해액을 통해 이동
- 충전기는 전자가 양극 -> 음극 방향으로 이동할 수 있도록 하기 위해 음극의 전압을 인위적으로 높이고, 완전 방전 상태에서 중성을 띄며 양극에 존재하는 라튬산화물을 산소와 분리시켜 반응성이 높은 리튬원자로 만듦
- 충/방전 Cycle 횟수에 따라 Li-Ion Cell의 용량이 선형적으로 감소 -> 사용된 방전 전류에 따른 비율
- 용량 비율의 감소는 Cell 내부 활물질들의 손실이 원인. 나머지들은 사라진게 아니라 사용되지 않는 것
- 증가한 저항을 반영하지 않고 Cutoff Voltage를 고정하면 Cell의 과충/방전이 발생
- 충전 시의 Top Cutoff Voltage를 높이고 방전 시의 Bottom Cutoff Voltage를 감소시켜 해결 가능
(V=IR Compensate 사용) - IR Drop : Vcc -> GND 사이의 임피던스 저항 성분으로 인해 전압이 강하되는 현상
- IR Compensate : 위 IR Drop으로 인한 전압 강하를 보상하는 과정. 전류가 너무 높으면 사용
- 각 Cell의 저항을 측정할 수 있고 그에 따라 Cell의 Cutoff Voltage를 조정할 수 있는 BMS를 통해 배터리의 용량을 더 효율적으로 사용 가능
2.4. 리튬이온배터리의 종류
- 양극재의 종류에 따른 구분
1) LCO - LiCoO2 (Lithium Cobalt Oxide. 리튬코발트산화물)

- 파란색 구가 Cobalt 원자, 빨간색이 Oxygen 원자, 보라색이 리튬 원자
- 리튬의 양은 변할 수 있으나 파란색 팔면체로 표현된 Cobalt - Oxygen 구조는 고정되어 있다
- Layered 구조 : 산소로 만들어진 팔면체 구성 층들이 규칙적으로 쌓여있는 구조
- 넓고 평평한 층 사이로 리튬이온을 많이 보관할 수 있어 에너지 용량이 높으나 안정성이 떨어짐
- 리튬 원자가 Cobalt와 Oxide 층을 분리시키는 기둥 역할을 한다
- 만약 리튬이 너무 많이 사라지면 결정 구조가 무너져 리튬이 층 사이로 더이상 들어갈 수 없게 된다
- 이를 방지하기 위해 이론적 용량 중 절반 정도만이 사용 가능하다
- 휴대용 전자기기 등의 소형 이차 전지에 많이 사용된다
- Cobalt가 희귀하여 비싸고 독성을 지녀 더 큰 Application에서 사용하기엔 무리가 있다
- Nickel이 Cobalt를 대체하여 동일 용량 대비 더 높은 전압값을 가져 더 높은 에너지 밀도를 가지나 화재의 위험이 높다
- Nickel의 비율을 60% 이상으로 높인 배터리를 '하이니켈 배터리'라 부른다
- 하이니켈 배터리는 비싼 Cobalt의 비율을 줄이고 Nickel의 비율을 증가시켜 배터리의 용량을 증가시킴
- 이를 통해 EV의 주행거리를 확보할 수 있으나 안정성이 떨어짐
- Aluminium, Chromium, Magnanese 또한 대체제가 될 수 있다
- 종종 아래와 같은 전이 금속들의 결합이 사용되곤 한다
1-1) NCM - LNCMO (LCO + Nickel + Manganese)
- 가장 많이 사용되고 있는 양극재. 주로 EV에 사용됨
- 높은 출력과 에너지 밀도를 가져 EV의 주행 거리를 향상시킬 수 있음
- Nickel의 비중이 커질수록 배터리의 에너지 밀도가 높아짐
- 단 안정성이 낮고 수명이 짧다는 단점이 있음
- 내부의 Nickel이 에너지 밀도를 높이나, 높아진 에너지 밀도로 인해 안정성이 떨어짐
- Cobalt는 양극재의 부식을 막고 안정성을 높이는 역할을 함. 희귀하여 배터리 제조 원가의 20% 정도를 차지함
- Manganese는 배터리의 안정성을 높이는 역할을 함
1-2) NCA - LNCAO (LCO + Nickel + Aluminium)
- NCM과 달리 Nickel의 함량을 높여 더 높은 에너지 밀도와 용량을 가지나 불안정함
- 주로 소형 배터리에 사용
- Aluminum은 배터리의 출력을 높임
위의 NCM, NCA처럼 LCO를 기반으로 Nickel과 다른 원소가 합쳐저 양극재에
총 3가지의 원소가 사용되는 배터리를 '삼원계 배터리' 라고 함
- 위의 LCO, NCM, NCA 양극재 모두 '층상 구조'를 지님
2) LMO - LixMn2O4 (Lithium Manganese Oxide. 리튬망간산화물)

- 파란색 구가 Manganese, 빨간색이 Oxygen, Lithium이 보라색
- Manganese Oxide (이산화망간)이 'Cubic Spinel'으로 알려진 팔면체 결정 형태를 구성함
- Spinel 구조 : 사면체/팔면체로 구성된 격자 형태를 가지며 이로 인해 리튬이온이 다양한 통로로 들어올 수 있어 Cell의 저항을 낮추며 출력이 좋음
- MgAL2O4를 갖는 광물 Spinel의 이름을 따옴
- LixMn2O4의 'x'는 0~1 사이의 값을 가지나 2까지 올라갈 수 있음
- 단 x가 1보다 큰 경우, LMO가 Acidic(산성) 환경에서 높게 리튬화 될 때 Manganese가 산에 공격을 받아 전해질로 녹아들어 불안정해짐
- Acid / 염기
- LCO에서 Cobalt를 Manganese로 바꾼 배터리
- Manganese가 Cobalt에 비해 가격이 싸고 공급이 안정적이나 에너지 밀도가 낮다
- LMO는 현재 단독으로 쓰이기보단 EV용 배터리 산업에서 다른 소재들을 섞는데 첨가하는 용도로 사용된다
3) LFP - LixFePO4 (Lithium Iron Phosphate. 리튬인산철)

- Lithium과 FePO4(인산철)을 양극재로 사용
- 갈색 구가 Iron(철), 회색이 Phosphorus(인), 빨간색이 Oxygen, Lithium이 보라색
- FeO6가 갈색 팔면체를 형성하고, PO4가 회색 사면체를 형성함
- Olivine 구조 : 육면체 형태로, P-O(인-산소)가 강력하게 결합되어 있어 리튬이온이 모두 빠져나가도 구조를 유지할 수 있어 높은 안정성을 갖는다
- 리튬이 1차원적인 선형 통로로만 이동할 수 있고, 이로 인해 양극재가 저항성을 꽤 띄게 한다
- 이 높은 저항을 보상하기 위해 전극 입자의 크기를 매우 작게 설정하여 확산의 범위를 줄여 저항을 낮춘다
- 비싼 Cobalt 대비 가격이 저렴한 Iron Phosphate(인산철)을 사용하여 가격이 낮음
- 또한 독성이 낮고, 안정적인 전압 Profile로 인해 많이 사용된다
- 과충/방전으로 인한 사고 가능성이 낮고, Cell 열화 현상도 적어 수명이 길다
- -20°C정도의 저온 특성을 가짐
- 발열이 거의 없어 폭발 등의 위험이 매우 낮아 안정성이 높다
- 하지만 다른 양극재에 비해 0.5V 정도 낮은 전압을 생성하며 Nickel을 사용하지 않아 삼원계 배러티에 비해 에너지 밀도가 낮다
- 이로 인해 EV 탑재 시 주행거리가 상대적으로 짧다
- 또한 LFP의 질량 기준 리튬의 양 또한 낮아 특정 에너지를 낮춘다
- 최근 안정성이 주요 고려사항으로 떠올라 주목받고 있음
2.5. 리튬이온배터리의 위험성
- 리튬이온배터리에 사용되는 전해질의 유기 용매가 가연성을 지녀 화재의 위험이 있다
- 한번 화재가 발생했을 경우, 배터리가 금속 케이스로 덮여 있어 일반적인 소화재가 침투할 수 없고, 열폭주 발생 시 내부의 에너지가 모두 소진될 때 까지 끊임없이 열과 산소가 발생하여 화재 진압이 어렵다
- 또한 리튬은 물에 극심하게 반응하여 화재 발생 시 물을 끼얹으면 화재를 악화시킬 수 있다
- 또한 리튬이온배터리가 폭발할 경우, 화씨 1000도(섭씨 약 538도) 이상의 화재를 유발하고 심각한 3도 화상을 야기할 수 있다
2.5.1. 화재 발생 원인
- 배터리의 화재는 내부에서의 양극과 음극의 만남, 즉 내부 단락(Short)이 유발하는 열폭주가 원인이다
- 열폭주 (Thermal Runaway) : 어떠한 원인으로 온도가 증가하고, 그 과정에서 방출된 에너지가 온도를 증가시켜 온도 증가가 가속되어 제어할 수 없을 정도로 상승하는 현상
- 배터리의 경우 배터리의 내부 온도가 제어할 수 없을 정도로 상승하는 현상
- 이로 인해 배터리의 압력이 상승하고 배터리가 부플어 오르며 유독성과 가연성을 지닌 가스가 누출된다
- 열폭주 발생 시 극판의 전기에너지가 모두 소진되기 전까지 다른 대책이 없음
- 이러한 열폭주를 발생시키는 원인은 아래와 같다
- Cell 제조상의 문제
- 양극, 분리막 등의 Cell 내부의 문제나 Pack / Module 내부의 배선 및 전기소자 관련 문제
- Pack / Module 내부의 수많은 Cell 중 단 하나만 문제가 있더라도 폭발할 수 있다
- 충 / 방전 과정에서의 이상
- 과충전, 과방전 등으로 인해 배터리의 내부 구조가 손상되고 이로 인해 내부 단락의 위험이 높아짐
- 방전의 경우 리튬 이온이 (-)극 -> (+)극으로 이동하는데, 이 때 내부 구리극판을 통해 비정상적으로 전자가 공급되면 극판이 녹고, 내부 단락의 가능성이 높아져 화학적 반응에 의한 발열이 일어남 (과충전도 마찬가지)
- 또한 리튬이온배터리는 전압이 0V가 되면 음극 표면에 덴드라이트(Dendrite)라고 하는 나뭇가지 모양의 결정체가 형성되는데, 이게 리튬 이온의 이동을 방해하고 성장하여 분리막을 손상시킬 수 있음
- 외부 충돌 후 단락, 고온 노출 등의 오용 문제
- 위와 같은 과충/방전을 방지하고 Balancing을 통해 배터리가 최적의 상태를 유지하도록 하는 System이 필요
- 이를 BMS(Battery Management System)으로 수행
3. BMS
3.1 BMS란
- Battery Management System의 약자로, 배터리의 상태를 모니터링하여 성능을 최대화하고 최적의 환경에서 사용할 수 있도록 제어하는 역할을 함
- 배터리의 충/방전 간에 Raw Data를 측정하고 그 Data를 바탕으로 배터리의 상태를 추정하여 성능을 최대화시킴
- Raw Data : 배터리의 Voltage, Current, Temperature Data를 의미. 뒤에서부터는 V, I, T라 칭함
- 최근 들어 높은 에너지 밀도와 낮은 자가 방전율 등의 이유로 인해 리튬이온배터리의 사용이 늘어나는 추세
- 단, 제대로 제어가 되지 않으면 발화 및 폭발이 발생하여 안정성 측면에서 문제가 생김
- 이러한 안전성을 보장하기 위해 BMS를 사용
- MCU가 HW에 들어있다는 Hardware적 성질과 프로그래밍이 가능하다는 Software적 성질을 모두 지님
- BMS의 Firmware적 성질
3.2. BMS의 역할
- BMS는 아래와 같은 동작을 통해 배터리 내의 Cell들이 각자의 SOA(Safe Operating Area)에서 동작하게 함
- Battery Monitor
- 여러 센서들을 통해 배터리 충/방전 시의 V, I, T Data 측정 및 고장 진단, 화재 감지 등을 수행
- Battery 보호
- 측정 Data를 통해 열 관리를 수행하거나 Cell Balancing을 통해 각 Cell들의 과충/방전을 방지함
- Battery 상태(SoX) 추정
- 배터리의 안정적 운용을 위해 측정 Raw Data를 기반으로 SoX를 계산하여 배터리의 상태 추정 및 그에 따른 제어
- SoX (State of X) : 배터리의 상태를 나타내는 여러 지표들을 포괄적으로 부르는 표현
SoC(State of Charge. 충전량), SoH(State of Health. 수명), SoP(State of Power. 전력) 등이 있다 - 상태 추정을 통해 얻은 노화 데이터를 바탕으로 아래의 전류 프로파일을 가변할 수 있다
- MCCCV : 여러 CC-CV 적용. CC-CV를 좀 더 세분화 한 것
- CP-CV : Power 일정
- CT-CV : 배터리가 버틸 수 있는 온도를 넘기지 않으며 충전 -> 온도 일정
- Boost Charging : EV에서 주로 사용
- Charge가 낮은 영역에서 순간적으로 고전류를 적용시키는 것. 이후 CC-CV를 따름
- Pulse Charging
- Battery 성능 최대화
- Balancing 등의 동작을 통해 배터리의 용량을 최대한으로 사용 가능하게 함
- CC-CV Charge (ConstantCurrent - ConstantVoltage Charge)
- CC-CV란 충전 시의 전류와 전압의 조건을 말하며, 일정 전류 또는 전압을 유지해 충전하는 방식을 뜻함
- Standard, Regulated Power Supply 방식. 아래의 2가지 충전 과정에 상응하는 2가지 방법으로 제한됨
- CC(정전류) : 일정한 전류를 계속 흘려보내 지정한 암페어로 충전
- 배터리의 내부 전압이 계속 상승함
- 주어진 시간 동안 충전할 수 있는 양이 정해져있음. 만약 완충에 도달하여 잔여 용량이 시간 당 충전 가능 용량보다 적을 경우 배터리에 무리가 될 수 있음
- CV(정전압) : 일정한 전압을 유지하여 지정한 볼트로 충전
- 내부 전압이 기준치에 도달하면 CV로 충전 조건을 변환하여 과전압을 방지. 전류는 서서히 줄여줌
- 충전 시간은 CC에 비해 느리나, 용량을 서서히 충전시켜 잔여 용량이 얼마 남지 않았을 경우
- 배터리의 충전 중지 시기를 전체 전압에 따라 결정하는 방식
- 충전 시작 시 우선 CC 방식을 통해 용량을 빠르게 충전시킴
- 이후 전압이 일정 수준에 도달하였을 경우 CV 방식을 통해 잔여 용량을 천천히 충전 시켜 과전압을 방지하며 안전하게 충전함
- 전류가 Cutoff 값에 도달하면 충전 완료

3.3. BMS 구조

- 배터리를 System 관점으로 보았을 때, Input은 Current, Output은 Voltage
- BMS는 Raw Data가 Input, SOx가 Output

- BMS의 구성 및 동작 흐름

- BMS의 구조는 크게 Hardware와 Software로 나눌 수 있다
- Hardware : 충/방전 시에 Raw Data를 측정하여 Software에 전달
- 배터리가 안전하게 충/방전될 수 있도록 제어
- 기존의 유선 통신 방식에서 최근 무선으로 변화
- Software : Hardware에서 전달된 Raw Data(I, V, T)를 바탕으로 여러 기술을 통해 SOx 계산
- SOx 정보를 바탕으로 배터리 제어 명령을 Hardware에 하달
- 배터리의 안전한 동작을 위해선 BMS의 Software가 상당히 중요
3.3.1 BMS Hardware
3.3.1.1 BMS`s Topology
- Topology : 통신 상의 다양한 Node, Device, Connction의 물리적 배치 및 연결을 의미
- 크게 분산형, 중앙집중형으로 나뉜다
1) 중앙집중형 (Centralized)

- 각 Cell로 연결되는 구조가 단일 Assembly 안에 모두 들어가있음. Compact하며 가장 저렴
- 문제 발생 시나 수리가 요구되면 단일 Assembly를 교체하기 편함
- 저용량, 저전압 : 일반 제어기, 원통형에 사용
2) 분산형 (Distributed)
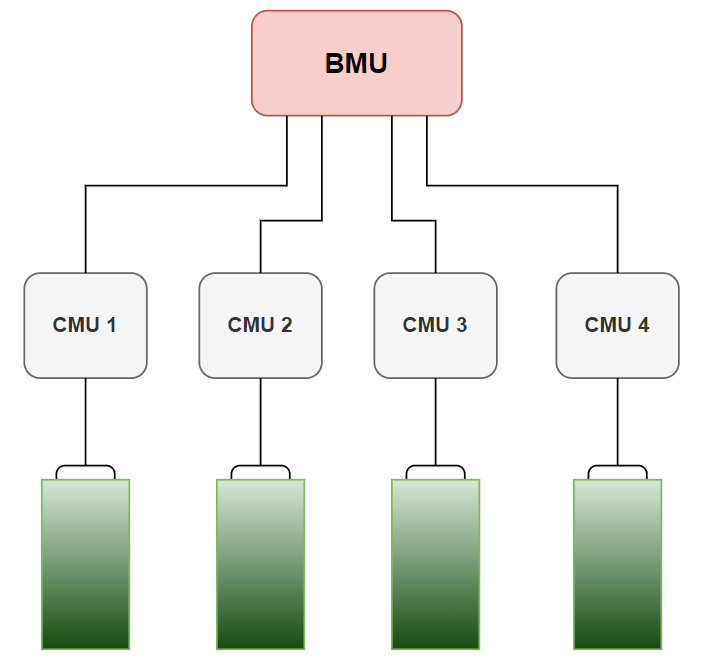
- Master - Slave 구조 : 계층을 나눔. ESS, EV 등에서 주로 사용
- Master : BMU(Battery Management Unit) : Module 레벨(상윗단)을 관리하며 하윗단과 상윗단을 관리
- 실질적인 측정은 하지 않고 계산과 통신만을 다룸
- Slave : CMU (Cell Monitoring Unit) : 배터리의 가장 기본 단위인 Cell(하윗단)을 Monitoring
- 중간에 Module을 거치지 않는 CTP(Cell To Pack) 형태도 있다
- CTP : 다수의 Cell으로 Pack을 구성하는 과정에서 Module Link를 제외하고 Cell을 Pack에 직접 통합한 후 그 Pack을 본체 Frame과 연결하는 방식
- 이를 통해 더 많은 Cell을 실을 수 있다
- 측정 정확도와 다기능, 안전 면에서 장점이 있다
- 고용량, 고전압 : 전문(전장용) 제어기, 각형, 파우치
- 고전용량, 고전압은 확인해야 할 부분이 많다
- 위의 Topology에 따라 통신부 설계가 달라짐
- SPI : 중앙집중형 (근거리, 동기식)
- CAN : 비동기식
- UART : 원/중장거리, 동기식
- 중앙집중형의 경우 전압 범위가 상대적으로 낮아 간섭의 영향이 없다
- 분산형의 경우 고전압을 사용하여 서로에 대한 간섭의 영향이 발생하므로 트랜스포머를 통한 절연 방식을 사용

- EV의 경우 각 자동차 Model의 대표 Module을 선정한 후 그 Module을 적층하는 구조를 달리하여 다른 차에 적용함
- 이를 모듈 표준화라고 함
3.3.1.2 전력 공급 관련
- 제어기 (MCU)는 기본적으로 DC 전압을 Source로 받음
- 이를 제공하는 동력을 배터리에서 제공하는데, 범용 / 전장용에 따라 적용이 다름
1) 범용 제어기
- 범용 제어기는 저전압, 저용량이므로 낮은 전압과 용량의 배터리를 그대로 가져옴
- 따라서 배터리를 3V 정도로 강하시켜 제어기의 전원으로 활용
- Ex) 48V -> 3V로 강하 후 직접 공급
- 이 과정에서 Buck(Switching Regulator) 사용
- Switching Regulator : 출력 전압이 원하는 값이 될 때까지 Switch를 연결하여 전압 공급원에서 부하로 전력을 공급
- 원하는 값에 도달하면 Switch 연결을 해제
- 위의 동작을 고속으로 반복하여 출력 전압을 원하는 범위 내로 조절

2) 전문가용 제어기
- 전문가용 제어기는 고전압, 고용량이므로 높은 전압의 배터리를 사용
- 이를 제어기의 전원으로 바로 사용하기엔 무리가 있음
- 따라서 12V / 24V 정도의 전압 공급을 위한 추가 외부 전원이 들어감
- 여기에 LDC(Low voltage DC-DC Converter)가 들어감
- ESS의 경우 충전에 PCS를 사용
- PCS (Power Converting System) : 전력을 배터리에 저장 / 방출하기 위해 전기의 특성을 변환해주는 System
(DC <---> AC로 변환)- ESS를 통해 배터리에 저장할 수 있는 전기는 DC 형태이나 일반 전자기기를 통해 공급받을 수 있는 전기는 AC
- PCS는 AC - DC를 양방향으로 전환시켜 에너지의 충전과 송전을 모두 가능하게 함
- 이 외에도 ESS의 유효/무효 전력 등 전기 품질을 제어하고 전압과 운전 상태를 감시하는 감시/제어 역할 수행
- 정전이 일어날 경우 전력 계통을 보호하는 계통 연계 보호 기능과 전원이 없는 경우에도 배터리를 활용하여 운전할 수 있게 해주는 독립 운전 기능 또한 함께 수행위의 AC - DC 간 서로 변환하는 것을 전력변환(Power Conversion)이라 하며, 이를 다루는 분야가 전력전자

- 참고 1 : 전력변환의 4가지 종류
- DC -> DC : Converter
- DC -> AC : Inverter
- AC -> DC : Rectifier(정류기), Charger, OBC(On Board Charger)
- AC -> AC : Cycloconverter
- 참고 2 : Relay 관련 내용

- Relay : 전류를 통해 제어할 수 있는 Switch (Power Relay Assembly)
- 동작 과정은 아래와 같다
- B에 전류 인가
- Inductor (Coil) 부근에 자기장 생성
- 자기장으로 인해 Switch가 닫힘
- B에 전류 제거
- Switch 분리
- 보통 작은 높이의 전압/전류로 더 높은 값의 전압/전류를 제어하는데 사용
- 위의 A, B 단이 Relay의 Spec을 결정
3.3.1.3. 측정부 관련
- SW에서의 SoX 추정에 필요한 V, I, T Data를 측정하는 부분
- 측정부에는 전압 분배기와 증폭기를 사용한다
- Op Amp (Operational Amplifier. 증폭기) : 두 입력값의 차이를 일정 비율로 증폭시켜 출력
- 미세한 센서의 측정값을 증폭시키는데 사용된다


- 측정된 값은 Analog Multiplexer에 의해 Sample되어 A/D Converter를 통해 Analog 신호에서 Digital 신호로 변환되고, 이 값이 Processor에 전달된다
- V, I, T 각각에 대한 측정 방식은 아래와 같다
- 전압

- Voltage Divider (전압 분배기) : 전압 강하 후 측정 저항에 걸린 전압을 측정

- 전류
- Shunt 저항과 Hall Sensor 2가지 방식 중 하나로 측정
- Shunt 저항 : 전류를 측정할 때 사용하는 저항으로, 측정부에 저항을 직렬로 연결한 후 그 양단의 전압을 측정하고 옴의 법칙을 통해 전류를 계산하는 방식
- 보통 매우 낮은 값의 저항을 사용한다
- Shunt는 분로를 만들어 전류를 갈라져 흐르게 한다는 뜻
- 회로의 특정 부분에 대한 전류를 측정할 때 사용됨
- 전류는 전압이 높은 곳 -> 낮은 곳으로 흐름
- 그 사이 전압의 편차가 얻어짐
- 거기에 저항을 배치하면 옴의 법칙에 의해 전류가 나옴


- Hall Sensor : Hall 효과 (자기장)를 이용하여 전류를 측정하는 방식 (자계에서 전류를 측정하는 방식)
- 여기서 얻은 전류값을 아래 식에 대입하여 용량을 알 수 있음
- Noise가 많은 경우는 맨 아래의 식 사용. Δ가 Noise를 의미

- 온도
- 열 가변 저항기인 서미스터를 사용해 측정
- Thermistor : Thermally Sensitive Resistor의 합성어로, 온도를 감지하는 저항기이다
- 온도에 따라 변화하는 저항값을 통해 측정 온도를 계산한다
- NTC, PTC, CTR 등의 종류가 있음
- 이 중 온도에 따른 저항의 경향이 가장 잘 나타나는 NTC를 주로 사용
- NTC (Negative Temperature Coefficient Thermistor) : 온도가 증가할수록 저항이 감소. 온도 측정 등의 일반적인 용도로 사용됨
- PTC (Positive Temperature Coefficient Thermistor) : 온도가 증가할수록 저항이 증가. 퓨즈 같이 과전류를 막는 역할에 주로 사용됨
- Noise가 많은 경우 센서 값에 Noise가 같이 누적되어 문제가 됨
- Noise로 인한 문제를 해결하기 위해 전류 센싱이 중요함
- Advanced Sensing Technology
- 정밀도가 높은 센서를 사용하면 좋으나 이는 가격 상승에 영향을 미침
- 따라서 정밀도가 높은 센서를 덜 사용하며 대신 센서의 최적의 위치를 선정하는 방식
- 센서의 위치에 따라 여러 데이터의 경중이 정해짐
- 따라서 BMS 관점에서 중요한 데이터가 잘 측정되는 곳 위주로 배치해야 함
3.3.1.4. 보호부 관련
- 배터리가 아닌 BMS를 보호
- MCU처럼 BMS에도 전원을 공급해야 하는데, BMS에 배터리 연결 시 스파크가 발생할 수 있음
- 이를 해결하기 위해 아래의 2가지 방법을 사용함
- 저항을 활용한 회로 설계
- 저항을 통해 전류를 제어하고 이를 통해 전압 하강을 일으켜 스파크 발생을 방지함
- 캐패시터를 활용한 회로 설계
- 위와 마찬가지로 캐패시터가 전하를 충전하여 전압 하강을 일으켜 스파크 발생 방지 (리플제거, 평활화)
- 또한 TVS 다이오드 / 퓨즈를 통해 BMS에 허용 이상의 스펙이나(과전류, 과전압 등) 이상한 값의 유입을 막을 수 있음
3.3.2. BMS SW
4. Cell Balancing
4.1 Cell Balancing이란
- EV, ESS 등의 System들은 고전압, 고용량을 위해 다수의 Cell을 직/병렬로 연결하여 사용한다
- 이러한 System을 충/방전 할 때, 여러 내/외부적인 요소들로 인해 Cell 간에 전압 차이가 발생한다
- 제조 상의 원인
- 내부 Leakage로 인한 Self Discharge 발생
- 이 때 BMS는 직렬로 연결된 Cell 간의 전압 차이를 조정하여 고르게 맞춰주는 역할을 함
- 위 과정을 'Cell Balancing'이라 함
- 즉 직렬로 연결된 Cell들의 전압을 동일하게 하여 SoC를 동일하게 하는 과정
- 이를 통해 배터리의 용량을 최대화하고 과충/방전을 방지하여 안전한 운용을 보장한다
- 배터리는 소모품이므로 Cell간 편차는 결국 발생하나 그 발생의 추이를 최대한 늦춰 오래 사용하는 것이 목적
- 이 Balancing 과정은 아래의 소자들을 통해 진행

- R(Resistor) : 소모의 역할. R을 기반으로 하는 Balancing이 Passive Balancing
- C(Capacitor) : 저장 / 방출의 역할. C를 기반으로 하는 Balancing이 Active Balancing
4.1.1 Cell Balancing과 용량의 상관성
1) 충전
- 충전 시 배터리가 Charge를 받아들일 수 있는 범위는 가장 먼저 완충되는 Cell에 의해 제한됨

- 위처럼 완충된 Cell이 생기면 나머지 Cell들의 용량이 남아있어도 충전을 중단시켜야 함
- 완충된 Cell이 과충전 될 수 있기 때문
2) 방전
- 방전 시 배터리가 Charge를 내보낼 수 있는 범위는 가장 먼저 완방되는 Cell에 의해 제한됨

- 위처럼 완방된 Cell이 생기면 나머지 Cell들의 용량이 남아있어도 방전을 중단시켜야 함
- 전류를 더 내보내면 완방된 Cell이 과방전 될 수 있으므로
- 위의 서로 다른 두 Cell이 Battery의 Capacity를 결정하며 대용량 배터리의 경우 큰 양의 Energy가 사용되지 못할 수 있다
- 위 점들은 Battery 전체의 Capacity를 감소시킴
- 충/방전이 더 가능한 Cell이 남아있어도 과충전 / 과방전 방지를 위해 하지 않음
- Balancing은 Cell이 충전과 방전을 제한하는 영역을 확장함으로써 배터리의 용량을 증가시킴
- 배터리가 Balanced 되면 용량은 같은 Cell의 양 끝점에 의해 제한됨
- 보통 가장 낮은 Capacity를 갖는 Cell. 극한의 상황에서는 가장 높은 저항을 갖는 Cell
4.2 Cell Balancing의 종류
1) 수동형(Passive) 셀 밸런싱

- Cell의 전압이 SoA 범위를 초과할 경우, 저항과 이어지는 스위치를 연결시켜 전압이 안전 범위로 돌아올 때 까지 방전시킴
- 열 방출을 통해 여분의 전하를 제거하는 방식
- 단순하고 비용이 낮다는 장점이 있으나 여분의 전압을 소비시키므로 에너지 효율성이 떨어진다
- 충전 중에만 적용할 수 있다.
2) 능동형(Active) 셀 밸런싱

- 직렬로 연결된 Cell들 중 다른 Cell에 비해 용량이 더 많은 Cell의 전하를 용량이 적은 Cell에 재분배해 모든 Cell의 SoC를 동일하게 만드는 방식
- 여분의 전압을 분배하므로 에너지 효율이 높고 충전 속도가 빠르다.
- 충/방전 모두 적용 가능하다
- 전압 분배를 위한 회로 구성이 복잡해 비용이 높다
- 이러한 Balancing 과정은 BMS 내부의 CMU(Cell Monitoring Unit)이 각 Cell의 상태를 측정하여 수행한다
- 최근에는 배터리 팩 설계 기술의 발전으로 Cell 간 편차이슈가 줄어듦
- 따라서 현재는 Active Balancing의 필요성이 줄어듦. 기술이 더 발전 시 Balancing이 아예 필요 없어질 수도 있음
5. 배터리 SoX 추정
5.1 SoC 추정
- 배터리의 전압, 인가 전류, 그리고 온도 정보를 바탕으로 사용 가능한 에너지량을 예측하는 과정
- 위 정보는 배터리의 과충/방전 방지와 사용 시간 예측 등에 사용됨
- 리튬이온배터리의 경우 과충전 시 배터리 폭발 및 화재의 위험이 있으므로 이 SoC 정보 파악이 중요함
- 배터리를 사용하는 System의 안정성을 위해 배터리의 충전 상태를 나타내는 지표인 SoC 추정이 필요함
- 단, 사용 중인 System 내 배터리의 SoC를 직접 측정할 순 없으므로 다양한 방법을 통해 추정해야 한다
- 현재 주로 사용되고 있는 SoC 추정 기법은 아래와 같다
5.1.1 Amphere Counting (전류적산법)
- 전하량(Coulomb)을 세는 방법으로, 배터리의 초기 SoC값에서 충/방전 Cycle 동안의 전류를 적분하여 계산한 값으로 SoC를 추정

- Cn은 배터리의 정격 용량
- 장점
- 단순한 구조로 구현이 용이하며 낮은 Algorithm 연산량으로 인해 Real Time Estimation이 가능
- SoC 추정에 전류의 누적 정보만을 사용하므로 BMS에 큰 부담을 주지 않음
- 단점
- SoC 추정 값이 초기 SoC에 전적으로 의지하게 됨
- 초기 SoC 값에 오차가 있을 경우 이를 해결할 수 없고 결국 전체 추정치에 오차가 생김
- 오차값이 SoC 추정 과정에서 지속적으로 누적된다
- 단순히 Coulomb을 적분하기 때문
- EV처럼 충/방전이 자주 일어나는 System의 경우 오차값을 일부 상쇄할 수 있음
- 단 ESS처럼 충/방전 후 장시간 사용하는 System의 경우 추정 오차값이 누적됨
- 또한 순간적인 충/방전이 일어나는 동적 System에는 누적오차가 커져 부적합함
- 오차 발생의 원인
- 초기 SoC 값의 오차 : 이후로의 모든 SoC 추정 값에 영향을 미침
- 따라서 초기 SoC 설정이 중요. 이를 위해선 OCV-SOC Look Up Table이 잘 구성되어 있어야 한다
- 여러가지 Hysteresis 특성들에 대한 반영이 제대로 되어있지 않으면 전류적산법으로 SoC 추정은 어렵다
- 전류 센서의 Noise의 누적
- 배터리 노화로 인한 Cn값 변화 미반영
- DSP를 통한 ADC 과정에서의 오차 : DSP의 Resolution 한계 및 반올림 과정에서의 오차
- 해결 방안
- Reset을 통한 오차값 제거
- 상단 / 하단 / 중간 SoC 영역에서 SoC Reset을 통한 오차값 제거 가능
- 전류 센서 ADC 과정에서의 오차 보정
5.1.2 OCV (Open Circuit Voltage)
- 배터리에 일정 휴지 기간을 준 뒤에 아래와 같은 OCV - SoC 관계를 통해 SoC를 추정하는 방식
- 위 방식은 측정 전압과 잔존 용량이 선형성을 가진다고 가정

- 장점
- 단순히 배터리의 전압만을 측정하면 되는 간편한 방식
- 단점
- 실제 배터리 사용 중에는 OCV 측정이 불가능하다
- OCV는 전류가 없는 상태에서 측정한 전압값이므로
- 배터리에 공급되는 충/방전 전류를 차단 후에도 배터리의 잔여 내부 전류가 남아있고, 이로 인해 OCV를 측정할 수 있는 안정 상태에 도달하기 위해선 휴지 기간을 거쳐야 한다
- 따라서 Real Time Estimation이 불가능하다
5.1.3 EKF (Extended Kalman Filter)
- Bayes Filter의 일종인 Kalman Filter를 통해 SoC를 추정하는 방식
- Kalman Filter : System을 어떤 Model로 모사한 후 그 Model을 통해 예측한 추정값과 실제 측정값의 차이를 기반으로 오차 공분산을 이용해 System의 현재 상태를 추정하는 Algorithm
- Filter : 어떤 신호에서 Noise 등의 원치 않는 신호를 차단하거나 원하는 신호만을 통과시키는 회로나 과정
- Kalman Filter는 Linear System에만 적용 가능하여, 배터리 같은 Non Linear System에 적용 가능하도록 변형된 Extended Kalman Filter를 사용
- 아래 조건을 만족하는 System을 Linear, 만족하지 않는 System을 Non Linear 하다고 한다

- 즉 Non Linear System은 독립변수(입력)와 종속변수(출력) 사이에 직접적인 관계가 없다
- Linear System은 몇가지 입력 만으로도 System의 특성을 파악할 수 있다
- 전기화학적 System인 배터리의 경우 등가회로를 통한 Modeling이 가능하다
5.1.3.1 Battery Modeling 관련
- BMS와 같은 전자 분야에선 Cell을 전자회로로 봄 : Electric Equivalent Model(Thevenin Equivalent Circuit Model)
- 아래처럼 Cell을 Voltage Source와 저항(보통 수 mΩ 단위)의 직렬 연결으로 보는 것이 가장 간단하고 효율적인 방법


- 위에서 설명한 저항은 Current Collector와 Terminal에서의 화학 작용과 Bulk Metal 저항으로 인해 발생하는 Effective Resistance의 직렬 연결에 의해 발생하는 저항
- 위의 단순한 회로에 Capacitor와 저항 하나의 병렬 조합을 직렬로 연결하면 Cell이 갑자이 Load되었을 때의 실제 행동을 정확히 모사할 수 있다


- R0, R1에 의한 전압 강하 발생 (시정수 Tc = R1 x C1). 이 현상을 Relaxtion 효과라고 함
- 시정수 (Time Constant) : 고유 응답이 입력이 0일 때의 1/e(36.8% 정도)로 감소하는데 걸리는 시간
- 즉 RC 직렬회로에서 직류 전원을 투입했을 때 콘덴서의 충전전압이 전원전압의 63.2%까지 충전되는 시간


- 따라서 EKF 사용시에는 왼쪽 형태의 등가회로를 ECM(Equivalent Circuit Model)로 사용하여 오른쪽의 인가 전류에 대한 배터리의 동적 반응을 모사한다
- 위처럼 하나의 직렬 저항에 RC 병렬구조(RC Ladder) 하나가 직렬로 연결된 구조가 기본
- Kirchhoff's Voltage Law, KVL에 따라 입력값 OCV에 대한 출력 Vt의 값은 아래와 같다

- 이 ECM의 Output인 Vt를 모사 전압이라 하며, 이를 실측 단자 전압과 비교
- 즉 ECM을 통해 실제와 유사한 모사 전압을 얻고, 이를 통한 배터리의 SoX 추정이 주 목적
- ECM은 위와 같은 방전 전류에 따른 전압의 과도 응답을 표현한 소자
- 과도 응답 (Transient Response) : 어떤 System이 하나의 정상 상태에서 다른 종류의 정상 상태로 옮겨가는 도중의 응답
- 각 Parameter에 대한 설명은 아래와 같다
- OCV(SOCk) : SOC에 따라 변하는 종속 전압
- R0 : 방전 전류의 유입에 따른 순간적인 전압 강하 모사
- RC Ladder : 이후의 동적 반응(과도응답) 부분 모사
- RC Ladder에는 주파수 성분이 있어 전압이 과도현상 곡선의 형태로 나옴
- 이러한 곡선의 특성을 동적 특성이라 표현함
- 배터리 Modeling의 성능은 이 동적 특성을 얼마나 잘 반영하느냐에 따라 달림
- 즉 Model의 이론으로부터 데이터를 분석하여 소자를 도출
- L(Inductor)는 고주파에서의 저장 및 방출의 역할을 하는데, 배터리는 고주파가 아니므로 사용하지 않음
- 위의 Parameter들은 실험을 통해 얻어야 함

- V0 : R0에 의한 전압
- V1 : RC Ladder에 의한 전압

- 위처럼 RC Ladder의 갯수가 많아질수록 위 전압의 과도응답 부분이 더 세분화되어 잘 반영됨
- 즉 동적 특성이 향상
- 단 RC Ladder가 많아질 수록 계산량또한 증가하여 무한히 늘릴 수는 없다
- ECM에 캐패시터가 있다고 배터리의 에너지가 그곳에 저장되는 것이 아님
- 단순히 전압의 형태를 모사하는데 캐패시터 소자가 사용되는 것
- 위 구조에서 필요에 따라 열(온도), 열화(노화) Model을 추가할 수 있다
- 각 Model 추가 시 Model의 구조보다는 각 소자의 값을 변경해줘야 함
- LFP의 경우 충/방전 OCV에 차이가 있으므로 이를 구분지어야 함
- NCM은 보통 방전 OCV를 사용

- 위의 ECM을 구성한 후 Extended Kalman Filter에 적용시켜 SoC를 추정할 수 있다
- Kalman Filter, Extended Kalman Filter에 대한 자세한 내용은 아래와 같다
https://youngseong.tistory.com/242
Kalman Filter란
0. 순서 1. Kalman Filter란 1.1 기본 개념 1.2 Kalman Filter 사용 이유 1.3 Kalman Filter 예시 2. Kalman Filter 동작 과정 2.1 전체 동작 과정 2.2 수식 2.3 상세 과정 2.3.1 System Model 관련 3. 관련 이론 3.1 Gaussian Distributi
youngseong.tistory.com
https://youngseong.tistory.com/247
Extended Kalman Filter란
1. Extended Kalman Filter란 Kalman Filter는 Linear System을 대상으로 함 (State Variable과 Noise가 Gaussian Distribution 형태를 갖는다 가정) 하지만 현실세계에선 대부분의 System이 Non-Linear System Non-Linear System에선 입
youngseong.tistory.com
- EKF를 통한 SoC 추정 전체 과정
- 배터리의 State Equation을 통해 현재 시점에서의 SoC 예측
- 예측 SoC를 OCV-SoC Look Up Table에 반영하여 현재 SoC에 해당하는 OCV 취득
- 위의 OCV를 등가회로의 입력으로 사용
- OCV가 등가회로에 인가된 후의 출력인 단자전압값을 Measure Equation을 통해 계산
- 위 과정을 통해 예측 단자 전압 값 취득
- 이 값을 실측 단자 전압값과 비교
- 둘의 차이값을 예측 SoC 값에 반영하여 보정
- 이를 통해 EKF의 결과값인 추정 SoC 값 취득
- 예측 SoC -> 추정 SoC
- 위 과정에 대한 자세한 설명은 아래와 같다
- https://youngseong.tistory.com/314
SoC Estimation by Extended Kalman Filter
- Kalman Filter, Extended Kalman Filter에 대한 글 https://youngseong.tistory.com/242 Kalman Filter란 0. 순서 1. Kalman Filter란 1.1 기본 개념 1.2 Kalman Filter 사용 이유 1.3 Kalman Filter 예시 2. Kalman Filter 동작 과정 2.1 전체 동
youngseong.tistory.com
- 장점
- 초기 예측값에 오차가 있더라도 위 과정을 재귀적으로 반복하여 실제 값에 가까워질 수 있음
- Noise에 대한 보정이 가능함
- 다른 방법론을 적용할수 있는 등의 확장성이 좋음
- 단점
- 등가회로 Parameter 값의 오차나 Non Linear System의 Linearization 과정에서 발생하는 오차, 추정 오차 공분산이나 초기 상태를 잘못 설정하면 큰 오차가 발생함
- Model(등가회로) 구성에 오차가 있으면 그 내용이 SoC 추정에 그대로 들어감
- 신뢰할 수 있는 Estimation을 위해 System에 대한 적절한 Modeling이 요구됨
- 상태 변수가 많아질 수록 계싼량이 많아짐
- Kalman Filter는 Noise가 Gaussian Distribution을 따른다 가정하므로 실제 Noise가 이와 다를 경우 Filter의 성능이 저하될 수 있다
Battery의 전기화학적 동작 특성을 정확히 표현하여 실제와 가까운 System Model을 구현하는 것이 중요
5.1.4 EIS
- 위의 DC Model 기반의 SoC 추정 기법과 달리 AC Model을 기반으로 SoC를 추정하는 방식
- EIS (Electrochemical Impedance Spectronization. 임피던스 분광법) : 주파수에 따른 Impedance 응답을 이용한 분석법
- Impedence 측정을 위해 AC 전원을 인가한 후의 출력값을 Nyquist Plot으로 옮겨 해석하는 것
- 아래 그림처럼 AC 전원은 주파수를 갖고 시간축으로는 원 운동을 함
- Nyquist Plot : Time Domain 상에서 어떤 값을 임피던스의 실수, 허수 성분으로 나눠 그린 그래프
- 위 Nyquist Plot을 해석하는 것을 EIS 분석법이라 함
- 전기화학 시료에 여러 Frequency의 AC 신호 인가 후 출력되는 V, I 값을 통해 Impedence 값을 뽑아냄
- 그 값들을 통해 시료를 분석
- 상세 내용 : https://youngseong.tistory.com/291
Randles Circuit 이란
1. Randles Circuit 전류가 흐르는 전극, 전해액 계면에서 일어나는 전기화학 반응을 전기회로로 모델링한 등가 회로 Rs : 전해액의 저항 표현 전해액의 전도도에 반비례하는 저항이 전류에 영향을 미
youngseong.tistory.com
5.1.2 경우에 따른 SoC 추정 성능 비교
- 전류 센서 Noise의 영향이 없을 경우 Amphere Counting 기법이 EKF보다 높은 SoC 추정 정확도를 보임
- 전류 센서 Noise의 영향이 있을 경우 EKF가 Amphere Counting보다 높은 정확도를 보임
- Amphere Counting은 전류 센서의 오차가 누적되어 방전 종단에서 큰 오차가 누적됨
- 전압 센서 Noise의 영향이 있을 경우 Amphere Counting이 EKF보다 높은 추정 정확도를 보임
5.2 SoH 추정
- SoC 추정의 EKF 식에 새로운 식을 추가하여 용량과 저항을 추정할 수 있다
- 즉 SoH를 추정할 수 있다
- 이렇게 다른 식 하나가 추가된 Dual EKF를 통해 SOC, SOH를 추정할 수 있다
- 단 SOC와 달리 SOH는 State로 지정하더라도 이를 직접 볼 수는 없다
- 배터리가 노화되면 용량을 감소하고 내부 저항은 증가함
- 위의 용량과 저항을 추정하여 아래의 SOH 오프라인 식에 대입
- 용량 추정은 SOC 중간 정도에선 정확도가 높으나 양 끝 부분에선 정확도가 떨어짐
$$ SOH_{Offline}=|\frac{C_P-C_{A}}{C_{F}-C_{A}}| $$
- 즉 배터리 노화에 따른 용량 변화를 아래 전류적산법 식의 Cn에 적용
- 상태방정식의 첫번째 식은 전류적산법 식
$$ SOC_{Final}=SOC_{Original}\pm \frac{\int_{0}^{t}idt}{C_{n}} $$
- 이러한 적용을 SOC 영역이나 노화를 적용했을 때의 대응까지 확장될 수 있다
- 단 SOC 영역 구분도 실험 기반의 데이터가 있어야 함
- 많은 실험을 그대로 놓을 수는 없으므로 대표값들의 결과값을 놓는다
- LO가 아닌 경우 1C 사용
- 혹 이론적으로 다루자 하면 Peukert`s Equation 사용
참고 자료 :
https://inside.lgensol.com/category/tech/battery-lab/
Battery LAB - 배터리인사이드 | BATTERY INSIDE
Battery LAB 2023.08.22 (인포그래픽#14) 양극재 구조 알아보기 리튬이온배터리를 구성하는 4대 소재 중 하나인 양극재는 배터리 사업의 경쟁력을 결정짓는 핵심 소재이기도 합니다. 양극재는 여러 원
inside.lgensol.com
https://www.samsungsdi.co.kr/column/all/gallery.html
PR CENTER - 칼럼(Column) | 삼성 SDI 공식 사이트
본 페이지는 핵심기술 및 경영정보 유출 제보를 위해 제작되었습니다. 부정관련 제보는 사이버감사 메뉴 내 제보하기 페이지에서, 기타 회사 및 사업관련 문의는 고객문의 페이지로 해주시기
www.samsungsdi.co.kr
https://skinnonews.com/archives/category/industry-and-insight/basics
트렌드 & 리포트 – SK이노베이션 뉴스룸 SKinno News
Industry > 트렌드 & 리포트
skinnonews.com
https://hanwhatotal.tistory.com/category/ChemiLOG
'ChemiLOG' 카테고리의 글 목록
한화토탈에너지스의 다양한 소식을 전합니다. 기업 소식, 임직원 인터뷰, 석유화학&에너지 이슈를 전해드립니다.
hanwhatotal.tistory.com
https://i-love-mystory.tistory.com/112
이제 모든 이해 끝!!! 배터리용량, 에너지양, 에너지 밀도의 차이 정리!
안녕하세요! 정리남입니다!^^ '이차전지'를 알아보면서, 간단한듯 하지만 조금 많이 헷깔리는 것이 있었습니다. 그래서 이번 포스팅은 배터리의 '용량, 에너지 밀도, 에너지양'에 대해 정리해 보
i-love-mystory.tistory.com
https://blog.naver.com/lagrange0115/222103678020
납산 배터리 원리 (납 축전지)
납산 배터리 (Lead-acid battery)는 납과 황산을 이용한 2차 전지입니다. (1차 전지는 재충전이 불가능한 ...
blog.naver.com
https://www.korea-autonews.com/entry/%EB%8B%88%EC%BC%88-%EC%88%98%EC%86%8C-%EC%A0%84%EC%A7%80Ni-MH
니켈 수소 전지(Ni-MH)
니켈 수소 전지(Ni-MH) 나켈-수소 전지는 니켈-금속수소화물 전지(MH는 metal hydride의 약자임)의 약칭으로 기존의 니켈-카드뮴(Ni-Cd) 전지에 카드뮴 음극의 중금속 오염을 개선하여 수소저장합금을
www.korea-autonews.com
https://blog.naver.com/stoppoint/222478810746
니켈 수소 전지 ( nickelhydride batteries, Ni-H 2 )
ISSFinalConfigEnd2006 국제우주정거장 니켈 수소 전지 ( nickelhydride batteries, Ni-H 2 ) 의 ...
blog.naver.com
전기차 원통형배터리의 이해 (구조, 장점, 단점)
원통형배터리는 우리가 일상에서 편하게 접할 수 있는 배터리이다. 보통 마트에서 주로 판매하는 AA나 AAA의 소형배터리를 주로 보았을 것이다. 하지만 전기차개발이 가속화되면서 보다 큰 사이
sm10053.tistory.com
https://maily.so/electricshock/posts/07e959f1
배터리 폼팩터 전쟁: 왜 테슬라는 원통형 배터리를 쓰나?
테슬라 배터리 이야기
maily.so
https://m.blog.naver.com/lagrange0115/222118218915?isInf=true
배터리 용어 (C-rate / OCV / 공칭 용량 / 공칭 에너지)
1. 용량 전류[A]는 전하량[C]/시간[s] 로 정의합니다. 그리고 배터리의 용량은 쿨롱 단위[C]를 사용하며...
blog.naver.com
https://www.edunet.net/nedu/contsvc/viewWkstContPost.do?contents_id=fs_a0000-2015-0702-0000-000000000200&head_div=s2015w
www.edunet.net
https://kidd.co.kr/news/184724
[에너지 칼럼] 배터리관리시스템의 중요 이슈 Ⅱ
[산업일보]우리에게 없어서는 안 될 휴대폰의 윗부분을 살펴보도록 하자. 핸드폰의 현 상태를 의미하는 여러 지표 중 숫자 혹은 배터리 모양의 아이콘을 쉽게 볼 수 있을 것이다. 이는 배터리의
kidd.co.kr
http://journal.auric.kr/jieie/XmlViewer/f396302
JIEIE - Journal of the Korean Institute of Illuminating and Electrical Installation Engineers
정대웅 (Dea-Ung Jeong) 1 송하나 (Ha-Na Song) 2 윤재중 (Jae-Jung Yun) † (Department of Electrical Engineering Hanyang University) (Department of Rehabilitation Industry from Daegu University) Copyright © The Korean Institute of Illuminating and
journal.auric.kr
https://ko.wikipedia.org/wiki/%EC%84%A0%ED%98%95%EC%84%B1
선형성 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 선형성(線型性, linearity) 또는 선형(線型, linear, 라틴어: linearis)은 직선처럼 똑바른 도형, 또는 그와 비슷한 성질을 갖는 대상이라는 뜻으로, 이러한 성질을 갖고
ko.wikipedia.org
https://www.rohm.co.kr/electronics-basics/dc-dc-converters/dcdc_what5
스위칭 레귤레이터 | DC/DC 컨버터란? | 전자 기초 지식 | 로옴 주식회사 - ROHM Semiconductor
Home> 전자 기초 지식> DC/DC 컨버터란?> 스위칭 레귤레이터 DC/DC 컨버터란? 스위칭 레귤레이터 스위칭 레귤레이터 출력전압이 필요한 전압이 될 때까지 스위치 소자 (MOSFET)를 ON하여 입력에서 출력
www.rohm.co.kr
'Study_Battery' 카테고리의 다른 글
| 배터리 관련 용어 정리 (0) | 2023.12.06 |
|---|